Các xét nghiệm miễn dịch hoạt động dựa vào sự kết hợp đặc hiệu giữa kháng nguyên và kháng thể, tạo thành phức hợp miễn dịch kháng nguyên kháng thể, đo phức hợp miễn dịch tạo thành để xác định nồng độ chất cần đo trong mẫu. Trong các xét nghiệm miễn dịch, cầu nối biotin – streptavidin được dùng để giữ phức hợp miễn dịch tạo thành cố định trên giếng phản ứng mà không bị rửa trôi. Gần đây, có nhiều báo cáo cho thấy rằng biotin là một trong những nguyên nhân làm sai lệch kết quả xét nghiệm miễn dịch đáng lưu ý.
Bài viết này gồm 3 phần sẽ phân tích cơ chế gây nhiễu của biotin lên các xét nghiệm miễn dịch, từ đó tóm tắt các xét nghiệm miễn dịch bị ảnh hưởng bởi biotin trên một số thiết bị.
- Phần 1 - Biotin là gì?
- Phần 2 – Cơ chế nhiễu của biotin lên các xét nghiệm hóa sinh miễn dịch là gì ?
- Phần 3- Sự ảnh hưởng của biotin trên một số thiết bị phân tích tự động
PHẦN 2 - CƠ CHẾ GÂY NHIỄU CỦA BIOTIN LÊN CÁC XÉT NGHIỆM HÓA SINH MIỄN DỊCH LÀ GÌ?
Các xét nghiệm hóa sinh miễn dịch được dùng để đo lường nhiều chất sinh học khác nhau trong cơ thể, bao gồm các protein, các hormone steroid, các marker ung thư, các vi chất, đo hàm lượng thuốc. Thông thường, có hai kiểu thiết kế xét nghiệm miễn dịch “sandwich” (không cạnh tranh) để đo lường các phân tử có kích thước lớn, ví dụ như TSH (thyroid stimulating hormone), cardiac troponin, các protein khác. Đối với các phân tử có kích thước nhỏ, thường sử dụng phương pháp “cạnh tranh”, ví dụ như hormone tuyến giáp, hormone steoid. Các phương pháp này đều cần đến cầu nối biotin-streptavidin trong quá trình tích, bởi vậy, biotin ngoại sinh có thể ảnh hưởng tới kết quả xét nghiệm, giảm giả tạo hoặc tăng giả tạo tùy vào phương pháp.
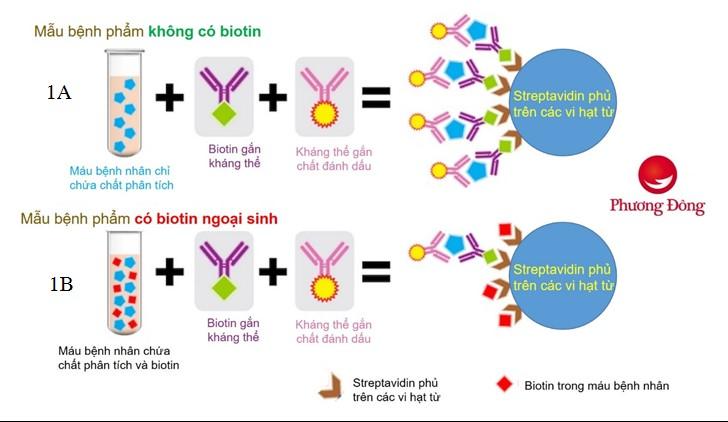
Hình ảnh 1A trên là phương pháp miễn dịch “sandwich”, mẫu bệnh nhân, biotin gắn kháng thể và kháng thể gắn chất đánh dấu (chất phát hiện), được thêm vào giếng, trên bề mặt giếng được phủ các streptavidin. Biotin gắn kháng thể liên kết với streptavidin, đây là giai đoạn của pha rắn. Các chất phân tích trong mẫu sẽ được kẹp giữa kháng thể gắn biotin và kháng thể gắn chất đánh dấu. Nhờ cầu nối biotin-streptavidin, phức hợp miễn dịch tạo thành sẽ được cố định trên giếng và không bị rửa trôi, các mẫu còn dư và các kháng thể gắn chất đánh dấu còn dư sẽ bị rửa trôi. Tín hiệu tạo thành sau phản ứng sẽ tỷ lệ thuận với nồng độ chất phân tích (1A). Tuy nhiên, nếu trong mẫu bệnh nhân có một lượng dư biotin ngoại sinh, những biotin tự do này sẽ gắn với streptavidin trong giếng, chúng chiếm vị trí liên kết của biotin gắn kháng thể với streptavidin trong giếng, do đó làm giảm phức hợp miễn dịch tạo thành (1B). Điều này tạo ra một kết quả xét nghiệm giảm giả tạo do tín hiệu thu được giảm.
Bên cạnh phương pháp miễn dịch sandwich, phương pháp miễn dịch cạnh tranh cũng được sử dụng phổ biến trong xét nghiệm hóa sinh miễn dịch. Trong phương pháp này, các chất cần phân tích và chất đánh dấu sẽ “cạnh tranh” vị trí gắn với kháng thể gắn biotin, kháng thể gắn biotin được “bắt giữ” bởi các streptavidin phủ trong giếng phản ứng (2A). Trong phương pháp này, khi không xuất hiện yếu tố nhiễu, cường độ tín hiệu thu được sẽ tỷ lệ nghịch với nồng độ chất cần đo, tức là nếu tín hiệu càng nhỏ thì nồng độ chất phân tích càng lớn (và ngược lại). Tuy nhiên, khi trong cơ thể bệnh nhân có một lượng dư biotin, biotin tự do sẽ gắn với streptavidin trên giếng chiếm vị trí của biotin gắn kháng thể. Khi đó, biotin gắn kháng thể vẫn liên kết với chất phân tích và chất đánh dấu, nhưng chúng không được cố định trên giếng, do đó sẽ bị rửa trôi, kết quả là thu được tín hiệu giảm giả tạo, dẫn tới tăng giả tạo chất cần phân tích trong mẫu (2B).
 Việc xuất hiện biotin ngoại sinh gây nhiễu kết quả xét nghiệm miễn dịch sẽ đánh lạc hướng chẩn đoán của bác sỹ lâm sàng. Ví dụ như xét nghiệm chức năng tuyến giáp, TSH thấp (phương pháp sandwich) cùng với T3 và T4 có nồng độ cao (phương pháp cạnh tranh), có thể dẫn tới chẩn đoán cường giáp. Đã có nhiều báo cáo trên thế giới về những trường hợp tương tự như thế này (12, 13-17).
Việc xuất hiện biotin ngoại sinh gây nhiễu kết quả xét nghiệm miễn dịch sẽ đánh lạc hướng chẩn đoán của bác sỹ lâm sàng. Ví dụ như xét nghiệm chức năng tuyến giáp, TSH thấp (phương pháp sandwich) cùng với T3 và T4 có nồng độ cao (phương pháp cạnh tranh), có thể dẫn tới chẩn đoán cường giáp. Đã có nhiều báo cáo trên thế giới về những trường hợp tương tự như thế này (12, 13-17).
Một số các thiết bị phân tích miễn dịch tự động có sử dụng cầu nối biotin-streptavidin nên sẽ bị nhiễu khi có biotin ngoại sinh. Mức độ nhiễu sẽ khác nhau tùy thuộc vào lượng biotin tự do trong mẫu và ngưỡng nhiễu đối biotin của từng xét nghiệm cụ thể cũng khác nhau. Nồng độ biotin tự do càng cao thì kết quả thu được càng sai lệch so với giá trị thực. Nếu thay đổi vẫn cho kết quả nằm trong khoảng tham chiếu thì có thể không ảnh hưởng tới diễn giải lâm sàng, nhưng nếu vượt mức quyết định lâm sàng có thể dẫn tới những chẩn đoán không phù hợp. Điều chú ý nữa là, không phải tất cả các xét nghiệm miễn dịch sử dụng cầu nối biotin – streptavidin cũng bị ảnh hưởng bởi biotin ngoại sinh, các cơ chế giải thích cho điều này chưa thực sự rõ ràng.
Tác giả: Lê Văn Công – Chuyên viên quản lý sản phẩm Phương Đông
Tài liệu tham khảo:
1. Diamandis EP, Christopoulos TKThe biotin-(strept)avidin system: principles and applications in biotechnology. Clin Chem 1991;37:625–36.
2. Zempleni J, Wijeratne SS, Hassan YI Biotin. Biofactors 2009;35:36–46
3. Zempleni J, Mock DM. Biotin biochemistry and human requirements. J Nutr Biochem 1999;10:128–38.
4. Peyro Saint Paul L, Debruyne D, Bernard D, Mock DM, Defer GL. Pharmacokinetics and pharmacodynamics of MD1003 (high-dose biotin) in the treatment of progressive multiple sclerosis. Expert Opin Drug Metab Toxicol 2016;12:327–44.
5. Wijeratne NG, Doery JC, Lu ZX. Positive and negative interference in immunoassays following biotin ingestion: a pharmacokinetic study. Pathology 2012;44:674–5
6. Soleymani T, Lo Sicco K, Shapiro J. The infatuation with biotin supplementation: is there truth behind its rising popularity? A comparative analysis of clinical efficacy versus social popularity. J Drugs Dermatol 2017;16:496–500.
7. Sedel F, Papeix C, Bellanger A, Touitou V, Lebrun-Frenay C, Galanaud D, et al. High doses of biotin in chronic progressive multiple sclerosis: a pilot study. Mult Scler Relat Disord 2015;4:159–69.
8. Tourbah A, Lebrun-Frenay C, Edan G, Clanet M, Papeix C, Vukusic S, et al. MD1003 (high-dose biotin) for the treatment of progressive multiple sclerosis: a randomised, double-blind, placebo-controlled study. Mult Scler 2016;22:1719–31.
9. Minkovsky A, Lee MN, Dowlatshahi M, Angell TE, Mahrokhian LS, Petrides AK, et al. High-dose biotin treatment for secondary progressive multiple sclerosis may interfere with thyroid assays. AACE Clin Case Rep 2016;2:e370–3.
10. Willeman T, Casez O, Faure P. Biotin in multiple sclerosis and false biological hyperthyroidism: mind the interference. Rev Neurol (Paris) 2017;173:173–4.
11. Siddiqui U, Egnor E, Sloane JA. Biotin supplementation in MS clinically valuable but can alter multiple blood test results. Mult Scler 2017;23:619–20.
12. Kwok JS, Chan IH, Chan MH. Biotin interference on TSH and free thyroid hormone measurement. Pathology 2012
13. Kummer S, Hermsen D, Distelmaier F. Biotin treatment mimicking Graves' disease. N Engl J Med 2016;375:704–6
14. Barbesino G. Misdiagnosis of Graves' disease with apparent severe hyperthyroidism in a patient taking biotin megadoses. Thyroid 2016;26:860–3.
15. Elston MS, Sehgal S, Du Toit S, Yarndley T, Conaglen JV. Factitious Graves' disease due to biotin immunoassay interference—a case and review of the literature. J Clin Endocrinol Metab 2016;101:3251–5.
16. Trambas CM, Sikaris KA, Lu ZX. A caution regarding high-dose biotin therapy: misdiagnosis of hyperthyroidism in euthyroid patients. Med J Aust 2016;205:192
17. Trambas CM, Sikaris KA, Lu ZX. More on biotin treatment mimicking Graves' disease. N Engl J Med 2016;375:1698.
18. Piketty ML, Prie D, Sedel F, Bernard D, Hercend C, Chanson P, et al. High-dose biotin therapy leading to false biochemical endocrine profiles: validation of a simple method to overcome biotin interference. Clin Chem Lab Med 2017;55:817–25.
19. Root M, Karger A, Killeen A, Larson K, Sokoll L, Li D. Biotin interference in thyroid panel assays with biotinylated components. Am J Clin Pathol. 2017;147(Suppl_2):S163.
20. Paxton A. Beauty fad's ugly downside: test interference. CAP Today. http://www.captodayonline.com/beauty-fads-ugly-downsidetest-interference/ (Accessed 2016).
21. Siemens Healthcare Diagnostics Inc. Urgent Field Safety Notice - TnI-UltraTM – Biotin Interference 2016. https://www.igz.nl/Images/IT1026645SiemensCC16-12UFSN2016-05-02ADVIACentaurTnI-Ultra_tcm294-375635.pdf.
22. Willeman T, Casez O, Faure P, Gauchez AS. Evaluation of biotin interference on immunoassays: new data for troponin I, digoxin, NT-Pro-BNP, and progesterone. Clin Chem Lab Med. 2017;55:e226–9.
23. Theobald JP, Algeciras-Schimnich A. Evaluation of biotin interference in Beckman Coulter immunoassays that use biotin-streptavidin in their assay design. 64th AACC Annual Scientific Meeting; July 2012; Chicago, IL.
24. Abbott. Why are physicians and laboratories worried about biotin? https://www.corelaboratory.abbott/us/en/offerings/assays/biotin-laboratorians.html (Accessed 2016).
25. Batista MC, Ferreira CES, Faulhaber ACL, Hidal JT, Lottenberg SA, Mangueira CLP. Biotin interference in immunoassays mimicking subclinical Graves' disease and hyperestrogenism: a case series. Clin Chem Lab Med 2017;55:e99–103.





